- Autore Jason Gerald [email protected].
- Public 2023-12-16 11:19.
- Ultima modifica 2025-01-23 12:21.
Se trovi la tavola periodica confusa e difficile da capire, non preoccuparti, non sei solo! Capire come funziona la tavola periodica può essere difficile, ma imparando a leggerla, avrai successo nella scienza. Inizia comprendendo la struttura sulla tavola periodica e le informazioni che mostra sugli elementi. Successivamente, puoi studiare ciascuno degli elementi. Infine, usa le informazioni elencate nella tavola periodica per scoprire il numero di neutroni in un atomo.
Fare un passo
Parte 1 di 3: Comprensione della struttura della tavola periodica
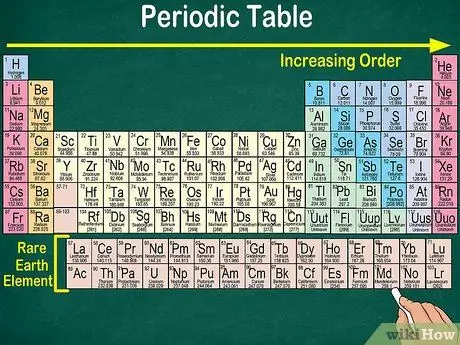
Passaggio 1. Leggi la tavola periodica dall'alto a sinistra in basso a destra
Gli elementi sono disposti secondo il loro numero atomico. Più a destra e in basso, più alto è il numero atomico. Il numero atomico è il numero di protoni che ha l'atomo di un elemento. Man mano che vai più a destra, noterai anche che il numero di massa di ciascun atomo aumenta. Cioè, puoi capire il peso di un elemento anche solo guardando la sua posizione sul tavolo.
- Più a destra o in basso, la massa atomica dell'elemento aumenterà perché la massa atomica viene calcolata sommando i protoni e i neutroni in ciascun atomo dell'elemento. Il numero di protoni aumenta con l'elemento, il che significa che aumenta anche il suo peso.
- Gli elettroni non sono inclusi nella massa atomica perché rispetto a protoni e neutroni, gli elettroni non hanno molto effetto sul peso atomico.

Passaggio 2. Comprendi che ogni elemento contiene 1 protone in più rispetto all'atomo alla sua sinistra
Puoi capirlo guardando il numero atomico. I numeri atomici sono disposti da sinistra a destra. Gli elementi sono anche separati in 3 gruppi, puoi vedere il raggruppamento nella tabella.
Ad esempio, la prima riga elenca l'idrogeno, che ha il numero atomico 1, e l'elio, che ha il numero atomico 2. Tuttavia, questi due elementi si trovano all'estrema sinistra e alla destra della tabella perché sono in gruppi diversi
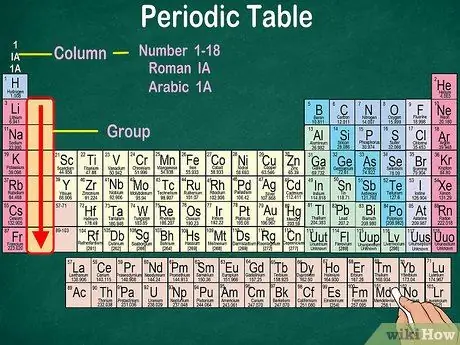
Passaggio 3. Identificare gruppi di atomi che hanno le stesse proprietà fisiche e chimiche
I gruppi sono indicati da colonne verticali. Nella maggior parte dei casi, i gruppi sono caratterizzati dallo stesso colore. Questo ti aiuta a identificare quali elementi hanno proprietà fisiche e chimiche simili. In questo modo sarà più facile prevedere le reazioni di questi elementi. Ogni elemento di un dato gruppo ha lo stesso numero di elettroni nel suo orbitale più esterno.
- La maggior parte degli elementi appartiene a un solo gruppo. Tuttavia, l'idrogeno può essere classificato come un alogeno o un metallo alcalino. In alcune tabelle, l'idrogeno appare in entrambi i gruppi.
- Nella maggior parte dei casi, le colonne saranno numerate da 1 a 18, nella parte superiore o inferiore della tabella. I numeri possono essere visualizzati in numeri romani (IA), numeri arabi (1A) o numeri (1).
- Leggi i gruppi atomici dall'alto verso il basso.
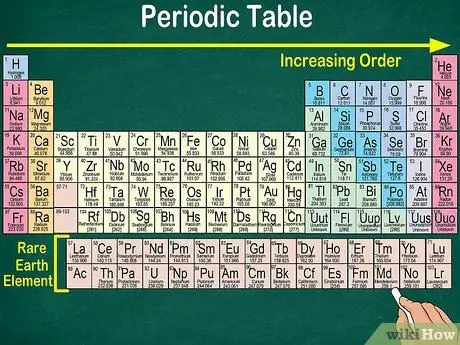
Passaggio 4. Notare lo spazio vuoto nella tabella
Oltre al numero atomico, la disposizione degli elementi in gruppi e gruppi tiene conto anche delle stesse proprietà fisiche e chimiche. In questo modo, capirai meglio come reagisce ogni elemento. L'aggiunta di elementi chimici rende più difficile la loro classificazione, quindi non sorprende che la tavola periodica contenga spazio vuoto.
- Ad esempio, le prime 3 righe hanno spazi vuoti, perché i metalli di transizione che appaiono nella tabella sono elementi che hanno numero atomico 21.
- Analogamente, gli elementi da 57 a 71, che sono elementi di terre rare o elementi di terre rare, sono rappresentati separatamente in basso a destra della tabella.
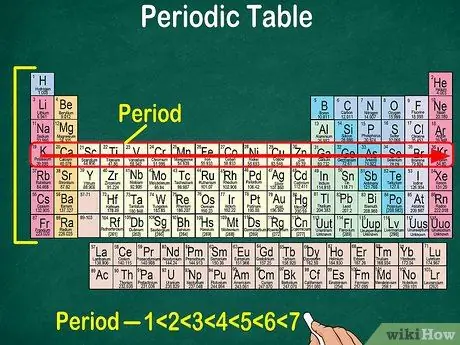
Passaggio 5. Notare che ogni riga è chiamata punto
Tutti gli elementi in un periodo hanno lo stesso numero di orbitali atomici, attraverso i quali passeranno gli elettroni. Il numero di orbitali corrisponderà al numero di periodi. La tavola periodica mostra 7 righe, il che significa che ci sono 7 periodi.
- Ad esempio, un elemento nel periodo 1 ha 1 orbitale, mentre un elemento nel periodo 7 ha 7 orbitali.
- Nella maggior parte dei casi, i periodi sono numerati da 1 a 7 dall'alto verso il basso sul lato sinistro della tabella.
- Leggi il periodo degli elementi che seguono la riga da sinistra a destra.
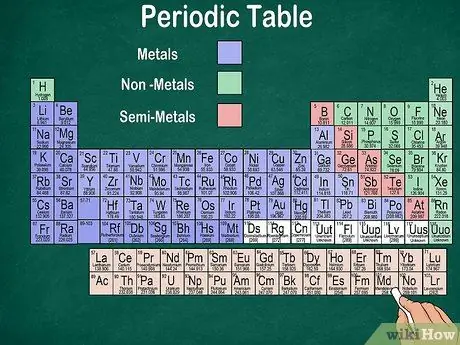
Passaggio 6. Distinguere tra metalli, semimetalli e non metalli
Puoi comprendere meglio le proprietà degli elementi riconoscendo il tipo di elemento. Fortunatamente, la maggior parte della tavola periodica usa il colore per indicare se un elemento è un metallo, un semimetallo o un non metallo. Troverai elementi metallici sulla destra del tavolo, mentre i non metalli sulla sinistra. Il gruppo dei semimetalli si trova tra metalli e non metalli.
- Ricorda che l'idrogeno può essere raggruppato con gli alogeni oi metalli alcalini a causa delle sue proprietà. Pertanto, è naturale che l'idrogeno appaia su entrambi i lati del tavolo o abbia un colore diverso.
- Un elemento è detto metallo se è lucido, solido a temperatura ambiente, conduce calore ed elettricità ed è morbido ed elastico.
- Un elemento è considerato un non metallo se non è lucido, non conduce calore o elettricità ed è duro. Questi elementi sono generalmente gassosi a temperatura ambiente, ma possono anche essere solidi o liquidi a determinate temperature.
- Un elemento è detto semimetallo se possiede le proprietà combinate di un metallo e di un non metallo.
Parte 2 di 3: studiare gli elementi
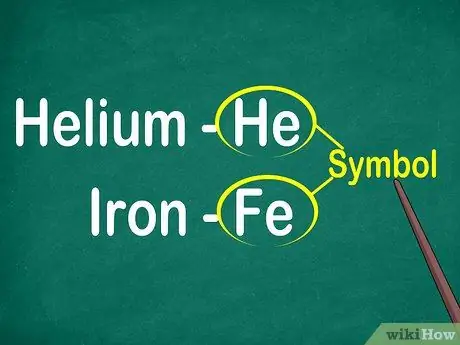
Passaggio 1. Identificare i simboli degli elementi da 1 a 2 lettere
Il simbolo si trova solitamente al centro di un quadrato con un carattere grande. I simboli sono abbreviazioni per i nomi degli elementi, che sono stati standardizzati in varie lingue. Quando fai esperimenti o lavori su equazioni elementari, probabilmente utilizzerai i simboli degli elementi. Pertanto, che ti piaccia o no, devi familiarizzare con i simboli elementali.
I simboli sono generalmente derivati dal nome latino dell'elemento, ma a volte derivano da nomi ampiamente utilizzati, in particolare nuovi elementi. Ad esempio, il simbolo di Helium è He, che sta per questo nome ben noto. Tuttavia, il simbolo del ferro è Fe, che è relativamente difficile da individuare a prima vista

Passaggio 2. Trova il nome completo dell'elemento, se presente
Questo è il nome dell'elemento che utilizzerai se devi scriverlo per intero. Ad esempio, "Helium" e "Carbon" sono i nomi degli elementi. Nella maggior parte dei casi, il nome dell'elemento è sotto il simbolo, ma la posizione può variare.
Alcune tavole periodiche potrebbero non includere il nome completo e utilizzare solo simboli
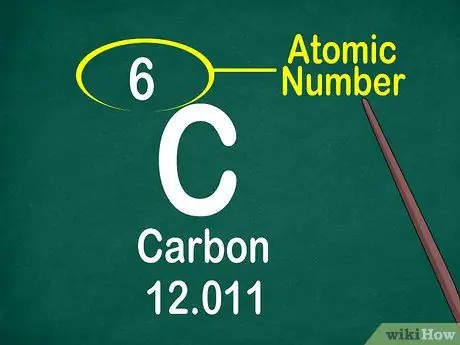
Passaggio 3. Annotare il numero atomico
Il numero atomico si trova di solito nella parte superiore della scatola, al centro o nell'angolo della scatola. Tuttavia, il numero atomico può trovarsi anche sotto il simbolo dell'elemento o il nome dell'elemento. I numeri atomici sono ordinati da 1-118.
Il numero atomico è un intero, non un decimale
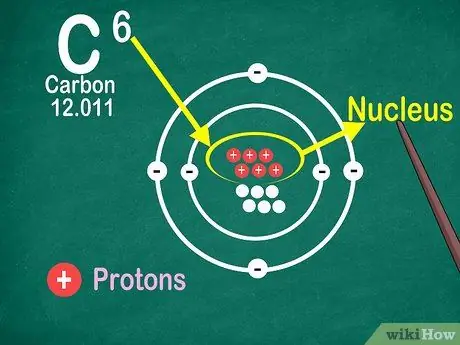
Passaggio 4. Sappi che il numero atomico è il numero di protoni nell'atomo
Tutti gli atomi di un elemento hanno lo stesso numero di protoni. A differenza degli elettroni, i protoni non possono essere catturati o rilasciati dagli atomi. Gli elementi cambieranno se gli atomi possono catturare o perdere atomi.
Hai anche bisogno del numero atomico per scoprire il numero di elettroni e neutroni
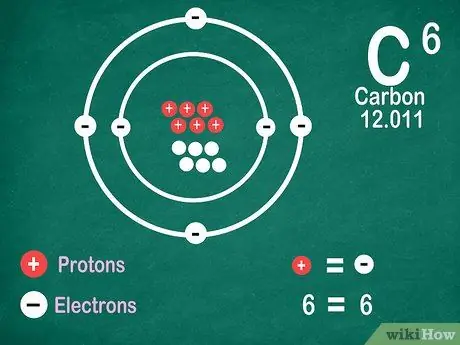
Passaggio 5. Sappi che gli elementi contengono lo stesso numero di elettroni dei protoni, a meno che l'elemento non subisca ionizzazione
I protoni hanno una carica positiva, mentre gli elettroni hanno una carica negativa. Poiché un atomo neutro non ha carica elettrica, significa che ha lo stesso numero di elettroni e protoni. Tuttavia, gli atomi possono perdere e guadagnare elettroni, il che li rende ionizzati.
- Gli ioni sono cariche elettriche. Se ci sono più protoni in uno ione, la carica è positiva, che è un segno positivo (+) accanto al simbolo dello ione. Se il numero di elettroni nello ione è maggiore, la carica è negativa, che è negativa (-).
- Non vedrai un segno positivo o negativo se un atomo non è uno ione.
Parte 3 di 3: utilizzo del peso atomico per contare i neutroni

Passaggio 1. Conoscere il peso atomico
Il peso atomico si trova solitamente nella parte inferiore della casella, sotto il simbolo dell'elemento. Il peso atomico è il peso combinato delle particelle nel nucleo atomico, inclusi protoni e neutroni. Tuttavia, gli ioni possono complicare il processo di conteggio. Quindi, il peso atomico indica la massa atomica media dell'elemento e la massa atomica dei suoi ioni.
- A causa del loro peso medio, la maggior parte degli atomi ha pesi atomici in forma decimale.
- Sebbene il peso di un elemento sembri aumentare da sinistra a destra, non è sempre così.
Passaggio 2. Determina il numero di massa dell'elemento che stai studiando
Puoi trovare il numero di massa arrotondando la massa atomica. Questo fatto dimostra che il peso atomico è la media di tutte le masse atomiche, inclusi gli ioni.
Ad esempio, il peso atomico del carbonio è 12,011, quindi è arrotondato a 12. Allo stesso modo, il peso atomico del ferro è 55,847, quindi è arrotondato a 56
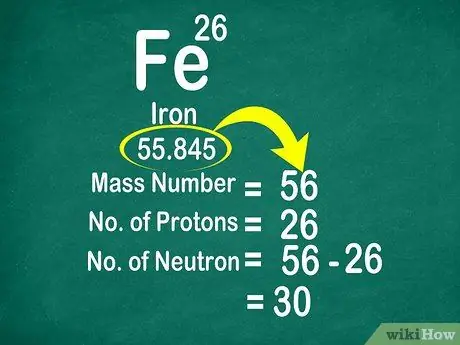
Passaggio 3. Sottrai il numero di massa dal numero atomico per contare i neutroni
Il numero di massa può essere calcolato sommando il numero di protoni al numero di neutroni. Questo ti renderà più facile calcolare il numero di neutroni in un atomo, sottraendo il numero di massa dal numero di protoni
- Usa questa formula: Neutrone = Numero di massa - Protone
- Ad esempio, il numero di massa del carbonio è 12 e ha 6 protoni. Quindi, possiamo sapere che il carbonio ha 6 neutroni perché 12 - 6 = 6.
- Un altro esempio, il numero di massa del ferro è 56 e ha 26 protoni. Quindi, sappiamo che il ferro ha 30 neutroni perché 56 - 26 = 30.
- Gli isotopi degli atomi contengono un numero diverso di neutroni, quindi i loro pesi atomici cambiano.
Suggerimenti
- Leggere la tavola periodica è difficile per alcune persone. Non scoraggiarti se trovi difficile studiare la tavola periodica!
- I colori nella tabella possono variare, ma il contenuto rimane lo stesso.
- Alcune tavole periodiche possono fornire informazioni incomplete. Ad esempio, alcune tabelle forniscono solo il simbolo e il numero atomico. Per questo, cerca un tavolo adatto alle tue esigenze!






